 |
|
Cập nhật về điều trị nhiễm virus viêm gan C mạn tính Genotype 1: Hướng dẫn thực hành năm 2011 của Hiệp hội nghiên cứu bệnh gan Mỹ
Những khuyến nghị này cung cấp những phương thức điều trị tích cực, những phương thức này có được nhờ những dữ liệu được thiết lập dựa trên những điều sau đây: (1) xem xét chính thức và phân tích y văn thế giới đã công bố gần đây về chủ đề này (tìm kiếm trên MEDLINE đến tháng 6, 2011), (2) Sổ tay hướng dẫn đánh giá thực hành y tế và thiết kế hướng dẫn thực hành của Hội bác sĩ Mỹ, (3) các chính sách hướng dẫn, bao gồm Chính sách của Hiệp hội nghiên cứu bệnh gan Mỹ (AASLD) về sự phát triển và sử dụng Hướng dẫn thực hành, Tuyên bố Chính sách của Hiệp hội tiêu hóa Mỹ về việc sử dụng Hướng dẫn thực hành y khoa và (4) kinh nghiệm của các tác giả về viêm gan C.
Những khuyến cáo này đề nghị các cách tiếp cận thích hợp hơn trên các phương diện chẩn đoán, điều trị và chăm sóc dự phòng, nhằm dành cho bác sĩ sử dụng. Các khuyến cáo được dự tính là linh động, ngược lại với điều trị chuẩn là những chính sách không linh động để tuân theo trong mọi trường hợp. Những khuyến nghị cụ thể được dựa trên các thông tin liên quan đã công bố. Để mô tả đầy đủ hơn về chất lượng của chứng cứ hỗ trợ cho các khuyến cáo, Ủy ban Hướng dẫn thực hành của Hiệp hội nghiên cứu bệnh gan Mỹ đòi hỏi Loại (phản ánh lợi ích so với nguy cơ) và Mức độ (đánh giá sức mạnh hoặc sự chắc chắn) của chứng cứ đã được chỉ định và được báo cáo với mỗi khuyến nghị (Bảng 1, phỏng theo Hội Tim mạch Mỹ và Hướng dẫn thực hành của Hiệp hội tim Mỹ).
I.Giới thiệu
Phương pháp điều trị chuẩn (SOC) cho các bệnh nhân bị nhiễm virus viêm gan C (HCV) mạn tính đã được sử dụng gồm cả peginterferon (PegIFN) và ribavirin (RBV). Những loại thuốc này đã được dùng trong 48 tuần (HCV genotype 1, 4, 5 và 6) hoặc trong 24 tuần (HCV genotype 2 và 3), đem lại tỷ lệ đáp ứng virus kéo dài (SVR) là 40% -50% ở những người nhiễm virus genotype 1 và 80% hoặc hơn ở những người nhiễm virus genotype 2 và 3. Một khi đã đạt được, đáp ứng virus kéo dài có liên quan với việc làm sạch lâu dài sự nhiễm HCV, được xem là một "sự chữa khỏi" về mặt virus học, cũng như cải thiện tỷ lệ mắc bệnh và tỷ lệ tử vong. Đã xuất hiện 2 tiến bộ lớn kể từ khi sự cập nhật hướng dẫn điều trị cuối cùng đối cho bệnh viêm gan C mạn tính (CHC) làm thay đổi chế độ điều trị tối ưu đối với nhiễm HCV mạn tính genotype 1: sự phát triển các thuốc kháng virus tác dụng trực tiếp (DAA) và sự xác định một số đa hình đơn nucleotide kết hợp với làm sạch sự nhiễm HCV tự nhiên và do điều trị.
Bảng 1. Hệ thống phân cấp độ về các khuyến cáo
Phân loại |
Mô tả |
Loại 1 |
Các tình trạng có chứng cứ và/hoặc thỏa thuận chung rằng sự đánh giá chẩn đoán, quy trình hoặc phương pháp điều trị đã dùng có lợi, hữu ích và có hiệu quả |
Loại 2 |
Các tình trạng có chứng cứ mâu thuẫn và/hoặc ý kiến khác nhau về tính hữu ích/hiệu quả của sự đánh giá chẩn đoán, quy trình hoặc phương pháp điều trị |
Loại 2a |
Tầm quan trọng của chứng cứ/ý kiến thiên về tính hữu ích/hiệu quả |
Loại 2b |
Tính hữu ích/hiệu quả được thiết lập tốt ít hơn bởi chứng cứ/ý kiến |
Loại 3 |
Các tình trạng có chứng cứ và/hoặc thỏa thuận chung rằng sự đánh giá chẩn đoán, quy trình/ phương pháp điều trị không hữu ích/hiệu quả và trong một số trường hợp có thể có hại |
Mức độ chứng cứ |
Mô tả |
Mức độ A |
Dữ liệu có nguồn gốc từ nhiều thử nghiệm lâm sàng ngẫu nhiên hoặc các phân tích tổng hợp |
Mức độ B |
Dữ liệu có nguồn gốc từ một thử nghiệm ngẫu nhiên duy nhất hoặc các nghiên cứu không ngẫu nhiên |
Mức độ C |
Chỉ có ý kiến đồng thuận của các chuyên gia, các nghiên cứu trường hợp hoặc điều trị chuẩn |
Mặc dù PegIFN và ribavirin vẫn là các thành phần quan trọng của việc điều trị, sự xuất hiện các thuốc kháng virus tác dụng trực tiếp đã dẫn đến cải thiện đáng kể về tỷ lệ đáp ứng virus kéo dài và lựa chọn phương pháp điều trị rút ngắn thời gian ở nhiều bệnh nhân nhiễm HCV mạn tính genotype 1. Vì vậy cần một sự sửa đổi các hướng dẫn điều trị trước đây, nhưng điều này dựa trên các dữ liệu hiện nay còn giới hạn. Do đó, có thể cần phải xem xét lại một số khuyến cáo khi có thêm dữ liệu. Những hướng dẫn này xem xét phương pháp điều trị nào đối với nhiễm HCV mạn tính genotype 1 hiện nay được xem là tối ưu, nhưng chúng không giải quyết vấn đề ưu tiên lựa chọn bệnh nhân để điều trị hoặc trị liệu cho các nhóm bệnh nhân đặc biệt.
II.Thuốc kháng virus tác dụng trực tiếp
Có nhiều bước trong vòng đời của virus đại diện cho các mục tiêu dược lý tiềm năng. Một số hợp chất bao gồm ít nhất 5 nhóm thuốc riêng biệt hiện đang được phát triển để điều trị viêm gan C mạn tính. Hiện nay, chỉ những thuốc ức chế protein 3/4A (NS3/4A) serine protease không cấu trúc của HCV đã được phê duyệt bởi Cục Quản lý Dược phẩm và Thực phẩm Mỹ (FDA).
Thuốc ức chế protease
NS3/4A serine protease cần cho việc sao chép RNA và lắp ráp hạt virus. Hai thuốc ức chế NS3/4A serine protease là boceprevir (BOC) và telaprevir (TVR) đã chứng tỏ ức chế mạnh sự sao chép của HCV genotype 1 và tỷ lệ đáp ứng virus kéo dài cải thiện rõ rệt ở bệnh nhân chưa từng điều trị và đã trải qua điều trị.Thử nghiệm phase 2 còn giới hạn đã cho thấy telaprevir (TVR) cũng có hoạt tính chống lại nhiễm HCV genotype 2 nhưng không chống lại genotype3.Về boceprevir, các dữ liệu còn giới hạn cho thấy nó cũng có hoạt tính chống lại nhiễm HCV genotype 2 nhưng còn chống lại genotype 3. Tuy nhiên, tại thời điểm này, không nên dùng thuốc để điều trị cho những bệnh nhân nhiễm HCV genotype 2 hoặc 3, và khi được dùng dưới dạng đơn trị liệu, mỗi thuốc ức chế protease chọn lọc nhanh đối với các biến thể kháng thuốc, dẫn đến thất bại về mặt virus học. Kết hợp từng thuốc ức chế protease với PegIFN và ribavirin làm hạn chế chọn lọc biến thể kháng thuốc và cải thiện đáp ứng với thuốc kháng virus.
A.Những bệnh nhân chưa bao giờ được điều trị (Bệnh nhân chưa từng điều trị)
1.Boceprevir. Thử nghiệm SPRINT-2 đánh giá boceprevir (BOC) trong 2 đoàn hệ gồm những bệnh nhân chưa từng điều trị: bệnh nhân da trắng và da đen. Số bệnh nhân ở đoàn hệ người da đen ít so với bệnh nhân ở đoàn hệ người da trắng và có thể không đủ để cung cấp một đánh giá đầy đủ về đáp ứng đúng trong nhóm bệnh nhân này. Tất cả bệnh nhân được điều trị lần đầu tiên bằng PegIFN alfa-2b và ribavirin dựa trên cân nặng dưới dạng điều trị dẫn đầu trong thời gian 4 tuần, tiếp theo là một trong ba chế độ điều trị: (1) boceprevir, PegIFN, và ribavirin được dùng trong 24 tuần nếu vào tuần thứ 8 của nghiên cứu (tuần thứ 4 của liệu pháp 3 thuốc), nồng độ HCV RNA trở nên không phát hiện được (như được định nghĩa trong tờ hướng dẫn sử dụng là < 10-15 IU/mL), được gọi là điều trị theo đáp ứng (RGT); tuy nhiên nếu nồng độ HCV RNA vẫn phát hiện được ở bất kỳ lần thăm khám nào từ tuần thứ 8 trở đi nhưng không bao gồm tuần 24 (tức là đáp ứng virus chậm), ngừng dùng boceprevir và bệnh nhân được điều trị chuẩn thêm 20 tuần (2) Boceprevir, PegIFN và ribavirin dùng trong một thời gian cố định 44 tuần; và (3) PegIFN alfa-2b và ribavirin dựa trên cân nặng dùng đơn độc tiếp tục thêm 44 tuần, đại diện cho điều trị chuẩn. Liều boceprevir là 800 mg, dùng đường uống 3 lần/ngày cùng với thức ăn. Tỷ lệ chung về đáp ứng virus kéo dài cao hơn ở nhóm dùng boceprevir, (63% và 66% tương ứng) so với ở nhóm điều trị chuẩn (38%), nhưng khác nhau theo chủng tộc (Hình 1). Tỷ lệ đáp ứng virus kéo dài trong số bệnh nhân da trắng là 67% ở nhóm điều trị theo đáp ứng, 69% ở nhóm thời gian cố định và 41% ở nhóm điều trị chuẩn tương ứng. Ở bệnh nhân da đen, tỷ lệ đáp ứng virus kéo dài là 42% ở nhóm điều trị theo đáp ứng, 53% ở nhóm điều trị trong thời gian cố định, và 23% ở nhóm điều trị chuẩn tương ứng (Hình 1). Tổng cộng có 54% người da trắng dùng boceprevir trải qua đáp ứng virus nhanh (RVR, HCV RNA không phát hiện được, < 10-15 IU/mL vào tuần thứ 8, khoảng thời gian này được chọn do điều trị dẫn đầu 4 tuần). Ngược lại, chỉ có 20% người da đen dùng boceprevir trải qua đáp ứng virus nhanh. Không kể chủng tộc, trong số những bệnh nhân có HCV RNA âm tính ở tuần thứ 8 (~ 57% trong cả hai nhóm boceprevir và 17% ở nhóm điều trị chuẩn, tỷ lệ đáp ứng virus kéo dài là 88% ở nhóm điều trị theo đáp ứng, 90% ở nhóm điều trị trong thời gian cố định và 85% ở nhóm điều trị chuẩn, so với tỷ lệ đáp ứng virus kéo dài là 36%, 40% và 30% tương ứng, nếu HCV RNA vẫn còn phát hiện được ở tuần thứ 8 (Hình 2).

Hình 1. Tỷ lệ chung về đáp ứng virus kéo dài (SVR) và theo chủng tộc, ở bệnh nhân bị nhiễm HCV mạn tính genotype 1 chưa từng điều trị: Boceprevir (BOC) cộng peginterferon (pegIFN) và ribavirin (RBV) so với điều trị chuẩn (SOC). Tất cả các bệnh nhân được điều trị lần đầu tiên bằng PegIFN + ribavirin trong 4 tuần dưới dạng điều trị dẫn đầu, tiếp theo là một trong ba chế độ điều trị: (1) Boceprevir/PegIFN/ribavirin điều trị theo đáp ứng (RGT) - liệu pháp 3 thuốc trong 24 tuần với điều kiện nồng độ HCV RNA âm tính từ tuần thứ 8 đến 24 – điều trị theo đáp ứng; những người có nồng độ HCV RNA phát hiện được từ tuần thứ 8 đến 24 đã được điều trị chuẩn thêm 20 tuần; (2) Boceprevir/PegIFN/ribavirin trong thời gian cố định - liệu pháp 3 thuốc trong thời gian cố định 44 tuần; và (3) điều trị chuẩn – gồm PegIFN và ribavirin dựa trên cân nặng, dùng trong 48 tuần.
Trong phân tích các phân nhóm, tỷ lệ đáp ứng virus kéo dài cao hơn trong chế độ điều trị chứa becoprevir trên tất cả các biến số trước khi điều trị đã được xác định trong các nghiên cứu trước đó ảnh hưởng đến đáp ứng với điều trị chuẩn, bao gồm xơ hóa tiến triển, chủng tộc và tải lượng virus viêm gan C cao trước điều trị. Hơn nữa, tỷ lệ đáp ứng virus kéo dài ở các phân nhóm tương tự ở nhóm điều trị theo đáp ứng và nhóm điều trị trong thời gian cố định, vì vậy AASLD và FDA khuyến cáo hỗ trợ sử dụng điều trị theo đáp ứng cho những bệnh nhân không có xơ gan chưa từng điều trị. FDA khuyến cáo không nên áp dụng điều trị theo đáp ứng cho bệnh nhân xơ gan còn bù, tuy nhiên điều này được dựa trên dữ liệu còn hạn chế và cần nghiên cứu thêm. Lưu ý, nếu đáp ứng virus không thỏa mãn các tiêu chuẩn cho điều trị theo đáp ứng, tức là một đáp ứng virus chậm, FDA khuyến cáo (dựa trên mô hình) dùng liệu pháp 3 thuốc trong 32 tuần, đi trước bằng 4 tuần điều trị chuẩn, tiếp theo là 12 tuần dùng PegIFN và RBV dùng đơn độc - một chiến lược khác với thiết kế thử nghiệm phase 3. Cần ngừng lại tất cả điều trị nếu nồng độ HCV RNA là ≥ 100 IU/mL ở tuần thứ 12 hoặc ≥ 10-15 IU/mL ở tuần thứ 24.
2.Telaprevir. Hai thử nghiệm phase 3 đánh giá hiệu quả của telaprevir kết hợp với PegIFN alfa-2a và ribavirin trong điều trị bệnh nhân bị nhiễm HCV genotype 1 chưa từng điều trị. Các bệnh nhân da đen đã được bao gồm vào nghiên cứu nhưng không phải là một đoàn hệ riêng biệt và không đủ số lượng để cung cấp một đánh giá đầy đủ về đáp ứng đúng trong nhóm bệnh nhân này. Trong thử nghiệm ADVANCE, bệnh nhân được cho dùng telaprevir cùng với PegIFN và ribavirin trong 8 tuần (T8PR) hoặc 12 tuần (T12PR), tiếp theo là PegIFN và ribavirin dùng đơn độc trong một mô hình theo đáp ứng. Liều telaprevir là 750 mg dùng đường uống mỗi 8 giờ cùng với thức ăn (đặc biệt bữa ăn nhiều chất béo). Bệnh nhân trong các nhóm T8PR và T12PR đạt được một "đáp ứng virus nhanh mở rộng" (eRVR) là đáp ứng mà đối với thuốc này được định nghĩa là nồng độ HCV RNA không phát hiện được (<10-15 IU/mL) ở tuần thứ 4 và 12, ngừng điều trị ở tuần thứ 24, trong khi những người không có đáp ứng virus nhanh mở rộng được dùng PegIFN và ribavirin tổng cộng 48 tuần. Tất cả bệnh nhân trong nhóm chứng được điều trị bằng PegIFN và ribavirin trong 48 tuần. Tỷ lệ chung về đáp ứng virus kéo dài trong số các bệnh nhân ở nhóm T8PR và T12PR là 69% và 75% tương ứng, so với tỷ lệ 44% ở nhóm chứng (Bảng 2 và Hình 3). Sử dụng cách tiếp cận điều trị theo đáp ứng, 58% và 57% bệnh nhân ở nhóm T12PR và T8PR tương ứng đã đạt được đáp ứng virus nhanh mở rộng, 89% và 83% trong số các bệnh nhân này cuối cùng đã đạt được đáp ứng virus kéo dài. Vì vậy, việc phát triển một đáp ứng virus nhanh mở rộng dường như là biến dự báo mạnh nhất về việc xảy ra đáp ứng virus kéo dài.
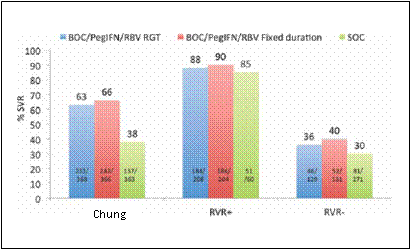
Hình 2. Tỷ lệ chung về đáp ứng virus kéo dài (SVR) và dựa trên đáp ứng virus nhanh (RVR, không phát hiện được HCV RNA vào tuần thứ 8 [tuần thứ 4 của liệu pháp 3 thuốc]) ở bệnh nhân bị nhiễm HCV mạn tính genotype 1 chưa từng điều trị: Boceprevir (BOC) cộng peginterferon (PegIFN) so với điều trị chuẩn (SOC). Tất cả bệnh nhân được điều trị lần đầu tiên bằng PegIFN + ribavirin trong 4 tuần điều trị dẫn đầu, tiếp theo là một trong ba chế độ điều trị: (1) Boceprvir/PegIFN/ribavirin điều trị theo đáp ứng (RGT) - bệnh nhân đã đạt được đáp ứng virus nhanh (không phát hiện được HCV RNA ở tuần thứ 8 [tuần thứ 4 của liệu pháp 3 thuốc) tiếp tục điều trị thêm 24 tuần (RGT - điều trị theo đáp ứng); nếu không phát triển đáp ứng virus nhanh, điều trị bằng liệu pháp 3 thuốc tiếp tục đến tuần thứ 28, tiếp theo là điều trị chuẩn trong 20 tuần. Điều trị chuẩn bao gồm PegIFN và ribavirin dùng trong 48 tuần. Lưu ý rằng số bệnh nhân kết hợp gồm có đáp ứng virus nhanh và không có đáp ứng virus nhanh không tương đương với tổng số bệnh nhân tham gia nghiên cứu, có lẽ do thiếu các trị số HCV RNA vào thời điểm tuần thứ 8.
Bảng 2. So sánh các thuốc ức chế protease kết hợp với Peginterferon Alfa (PegIFN) và Ribavirin (RBV) ở bệnh nhân chưa từng điều trị
Biến số |
Boceprevir (BOC)12 |
Telaprevir (TVR)16 |
Thiết kế nghiên cứu |
Thử nghiệm ngẫu nhiên có đối chứng (RCT) |
Thử nghiệm ngẫu nhiên có đối chứng (RCT) |
4 tuần điều trị dẫn đầu bằng PegIFN/RBV |
Có |
Không |
Thời gian dùng liệu pháp 3 thuốc |
24 tuần hoặc 44 tuần kết hợp với PegIFN/RBV* |
12 tuần, tiếp theo là 12 tuần hoặc 36 tuần với PegIFN/RBV† |
Điều trị theo đáp ứng (RGT) |
Có |
Không |
Thích hợp với điều trị theo đáp ứng (%) |
44 |
58 |
Đáp ứng virus kéo dài (SVR) (%) |
BOC44/PR: 66 |
T8PR: 69 |
Kết thúc đáp ứng điều trị (%) |
BOC44/PR: 76 |
T8PR: 81 |
Tái phát (%) |
BOC44/PR: 9 |
T8PR: 9 |
Đề kháng đang nổi lên với điều trị (%) |
16 |
12 |
Phản ứng phụ thường gặp hơn ở nhóm dùng liệu pháp 3 thuốc so với điều trị chuẩn (SOC) |
Thiếu máu, rối loạn vị giác |
Nổi ban, thiếu máu, ngứa, buồn nôn, tiêu chảy |
Phản ứng phụ dẫn đến ngừng điều trị (%) |
Không áp dụng (NA) |
12 |
Phản ứng phụ nghiêm trọng của thuốc nghiên cứu so với điều trị chuẩn (%) |
11 so với 9 |
9 so với 7 |
NA: Không áp dụng; PR: peginterferon cộng ribavirin; RCT: thử nghiệm ngẫu nhiên có đối chứng; SOC: điều trị chuẩn; SVR: đáp ứng virus kéo dài.
* Tất cả bệnh nhân được điều trị đầu tiên bằng PegIFN alfa-2b và ribavirin (RBV) dựa trên cân nặng dưới dạng điều trị dẫn đầu trong thời gian 4 tuần, tiếp theo là một trong ba phác đồ: (1) Boceprevir (BOC)/peginterferon cộng ribavirin (PR)/điều trị theo đáp ứng (RGT): Boceprevir, PegIFN và ribavirin được dùng trong 24 tuần nếu vào tuần thứ 8 của nghiên cứu (tuần thứ 4 của điều trị bằng 3 thuốc), nồng độ HCV RNA trở nên không phát hiện được (như được định nghĩa trong tờ hướng dẫn sử dụng thuốc là < 10-15 IU/mL), được gọi là điều trị theo đáp ứng, tuy nhiên nếu nồng độ HCV RNA vẫn phát hiện được tại bất kỳ lần thăm khám nào từ tuần thứ 8 trở đi nhưng không bao gồm tuần thứ 24 (tức là một đáp ứng virus chậm) thì ngừng dùng boceprevir và bệnh nhân được điều trị chuẩn thêm 20 tuần; (2) BOC44/PR: Boceprevir, pegIFN và ribavirin dùng trong một thời gian cố định 44 tuần, và (3) điều trị chuẩn: pegIFN alfa-2b và ribavirin dựa trên cân nặng dùng đơn độc tiếp tục thêm 44 tuần.
† Điều trị bằng telaprevir cộng peginterferon và ribavirin (PR) trong 8 tuần (T8PR) hoặc 12 tuần (T12PR) so với điều trị chuẩn (SOC). Bệnh nhân trong nhóm T8PR và T12PR đạt được "đáp ứng virus nhanh mở rộng", là đáp ứng mà đối với thuốc này được định nghĩa là nồng độ HCV RNA không phát hiện được (<10-15 IU/mL) ở tuần thứ 4 và 12, ngừng điều trị ở tuần thứ 24, trong khi những người không có đáp ứng virus nhanh mở rộng được dùng PegIFN và ribavirin tổng cộng 48 tuần. Tất cả bệnh nhân trong nhóm chứng được điều trị bằng PegIFN và ribavirin trong 48 tuần.
Tỷ lệ đáp ứng virus kéo dài cao hơn trong các chế độ điều trị có telaprevir so với điều trị chuẩn trong số bệnh nhân với đặc điểm bệnh được tìm thấy trước đây liên quan đến đáp ứng kém hơn với điều trị chuẩn. Mặc dù vài bệnh nhân da đen và nhóm bệnh nhân khó điều trị khác được bao gồm vào thử nghiệm telaprevir phase 3, đã quan sát thấy tỷ lệ đáp ứng virus kéo dài được cải thiện không kể đến chủng tộc, dân tộc hoặc mức độ xơ hóa gan. Về chủng tộc, việc trị liệu bằng một chế độ điều trị dựa trên telaprevir đã cải thiện đáng kể tỷ lệ đáp ứng virus kéo dài ở các bệnh nhân da đen (T8PR 58% và T12PR 62%) so với tỷ lệ đáp ứng virus kéo dài đã đạt được ở những người được dùng chế độ điều trị chuẩn (25%) (Hình 3). Hơn nữa, tỷ lệ đáp ứng virus kéo dài > 80% trong số bệnh nhân da đen là những người đã đạt được đáp ứng virus nhanh mở rộng khi dùng chế độ điều trị dựa trên telaprevir. Tổng cộng có 62% bệnh nhân ở nhóm T12PR và 53% ở nhóm T8PR bị xơ hóa tiến triển đã đạt được đáp ứng virus kéo dài, tỷ lệ cải thiện đến >80% trong số những người có đáp ứng virus nhanh mở rộng. Trong nhóm T12PR, ảnh hưởng của tải lượng virus cao so với tải lượng virus thấp (> 800.000 hoặc < 800.000 IU/mL) về tỷ lệ đáp ứng virus kéo dài là rất ít, tỷ lệ đáp ứng virus kéo dài là 74% ở bệnh nhân có tải lượng virus cao và 78% ở bệnh nhân có tải lượng virus thấp.
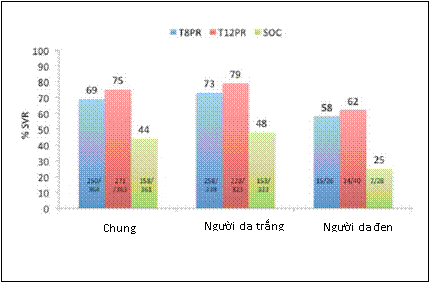
Hình 3. Tỷ lệ chung về đáp ứng virus kéo dài (SVR) và theo chủng tộc trong điều trị những bệnh nhân bị nhiễm HCV mạn tính genotype 1 chưa từng điều trị: Điều trị bằng telaprevir cộng peginterferon và ribavirin (PR) trong 8 tuần (T8PR) hoặc 12 tuần (T12PR) so với điều trị chuẩn (SOC). Những bệnh nhân trong nhóm dùng liệu pháp 3 thuốc phát triển đáp ứng virus nhanh mở rộng (eRVR, được định nghĩa là nồng độ HCV RNA không phát hiện được vào tuần thứ 4 và 12) ngừng điều trị vào tuần thứ 24 (điều trị theo đáp ứng - RGT); nếu không phát triển đáp ứng virus nhanh mở rộng, tiếp tục điều trị đến 48 tuần. Điều trị chuẩn gồm PegIFN và ribavirin dùng trong 48 tuần.

Hình 4. Tỷ lệ đáp ứng virus kéo dài (SVR) ở bệnh nhân bị nhiễm HCV mạn tính genotype 1 chưa từng điều trị: Kết quả chung của telaprevir (TVR) cộng peginterferon và ribavirin (PR) và ở những người đã đạt hoặc không đạt được đáp ứng virus nhanh mở rộng (eRVR; nồng độ HCV RNA không phát hiện được vào tuần thứ 4 và 12). Những bệnh nhân đã đạt đáp ứng virus nhanh mở rộng được chọn ngẫu nhiên vào tuần thứ 20 để được điều trị chuẩn thêm 4 tuần hoặc 28 tuần; những bệnh nhân không phát triển đáp ứng virus nhanh mở rộng không được chọn ngẫu nhiên và tất cả đều được điều trị chuẩn thêm 24 tuần.
Thử nghiệm ILLUMINATE tập trung vào việc xác định lợi ích của điều trị theo đáp ứng ở những bệnh nhân đạt được đáp ứng virus nhanh mở rộng. Tất cả bệnh nhân được dùng liệu pháp 3 thuốc dựa trên Telaprevir trong 12 tuần đầu tiên, tiếp theo bằng liệu pháp PegIFN và ribavirin dùng đơn độc. Những bệnh nhân đạt đáp ứng virus nhanh mở rộng được chọn ngẫu nhiên vào tuần thứ 20 để được điều trị thêm 4 tuần hoặc 28 tuần bằng PegIFN và ribavirin trong khi những người không đạt được đáp ứng virus nhanh mở rộng không được chọn ngẫu nhiên và được điều trị thêm 28 tuần bằng PegIFN và ribavirin. Tỷ lệ chung về đáp ứng virus kéo dài đối với tất cả bệnh nhân là 72% (Hình 4), tương tự như tỷ lệ 75% được tìm thấy trong thử nghiệm ADVANCE.22 Trong số 65% bệnh nhân đạt được đáp ứng virus nhanh mở rộng và được điều trị thêm 4 tuần hoặc 28 tuần bằng PegIFN và Ribavirin, tỷ lệ đáp ứng virus kéo dài là 92% và 88% tương ứng (Hình 4). Ngược lại, tỷ lệ đáp ứng virus kéo dài chỉ là 64% trong những bệnh nhân không đạt được đáp ứng virus nhanh mở rộng.22 Những dữ liệu này cho thấy chiến lược điều trị theo đáp ứng dựa trên sự đạt được đáp ứng virus nhanh mở rộng cho phép điều trị rút ngắn thời gian mà không ảnh hưởng xấu đến tỷ lệ đáp ứng virus kéo dài và có thể thích hợp đến hai phần ba số bệnh nhân nhiễm HCV mạn tính genotype 1. Tuy nhiên việc áp dụng điều trị theo đáp ứng có thể không phù hợp đối với bệnh nhân xơ gan, nhưng hiện nay không đủ dữ liệu để hướng dẫn quản lý nhóm bệnh nhân khó điều trị này. Nên ngừng điều trị ở tất cả bệnh nhân nếu nồng độ HCV RNA ≥ 1.000 IU/mL vào tuần thứ 4 hoặc 12 và/hoặc > 10-15 IU/mL vào tuần thứ 24.
Khuyến cáo:
1. Điều trị tối ưu đối với nhiễmHCV mạn tínhgenotype 1 là sử dụng boceprevir hoặc telaprevir kết hợp với peginterferon alfa và ribavirin (Loại 1, Mức độ A).
2. Không nên sử dụng boceprevir và telaprevir mà không có peginterferon alfa và ribavirin dựa trên cân nặng (Loại 1, Mức độ A).
Đối với bệnh nhân chưa từng điều trị:
3. Liều khuyến cáo của boceprevir là 800 mg, 3 lần/ngày dùng cùng với thức ăn (mỗi 7-9 giờ) cùng với peginterferon alfa và ribavirin dựa trên cân nặngtrong 24-44 tuần, được đi trước bởi điều trị dẫn đầu trong 4 tuần bằng peginterferon alfa và ribavirindùng đơn độc (Loại 1, Mức độ A).
4. Những bệnh nhân không xơ gan được điều trị bằng boceprevir, peginterferon và ribavirin, được đi trước bởi điều trị dẫn đầu trong 4 tuần bằng peginterferon và ribavirin, có nồng độ HCV RNA không phát hiện được vào tuần thứ 8 và 24, có thể được xem xét rút ngắn thời gian điều trị còn tổng cộng 28 tuần (điều trị dẫn đầu trong 4 tuần bằng peginterferon và ribavirin, tiếp theo là liệu pháp 3 thuốc trong 24 tuần (Loại 2a, Mức độ B).
5. Nên ngừng điều trị bằng tất cả ba loại thuốc (boceprevir, peginterferon alfa và ribavirin) nếu nồng độ HCV RNA > 100 IU/mL vào tuần điều trị thứ 12 hoặc nồng độ HCV RNA phát hiện được vào tuần điều trị thứ 24 (Loại 2a, Mức độ B).
6. Liều khuyến cáo của telaprevir là 750 mg, 3 lần/ngày uống cùng với thức ăn (không ít chất béo) (mỗi 7-9 giờ) cùng với peginterferon alfa và ribavirin dựa trên cân nặng trong 12 tuần, tiếp theo là điều trị thêm 12-36 tuần bằng peginterferon alfa and ribavirin (Loại 1, Mức độ A).
7. Những bệnh nhân không xơ gan được điều trị bằng telaprevir, peginterferon và ribavirin, có nồng độ HCV RNA không phát hiện được vào tuần thứ 4 và 12 cần được xem xét rút ngắn thời gian điều trị còn 24 tuần (Loại 2a, Mức độ A).
8. Những bệnh nhân xơ gan được điều trị với boceprevir hoặc telaprevir kết hợp với peginterferon và ribavirin nên được điều trị trong thời gian 48 tuần (Loại 2b, Mức độ B).
9. Nên ngừng điều trị bằng tất cả ba loại thuốc (telaprevir, peginterferon alfa và ribavirin) nếu nồng độ HCV RNA > 1.000 IU/mL vào tuần điều trị thứ 4 hoặc 12 và/hoặc nồng độ HCV RNA phát hiện được vào tuần điều trị thứ 24 (Loại 2a, Mức độ B).
B.Bệnh nhân đã được điều trị trước đây
Có 3 loại đã được xác định đối với với những người trước đây được điều trị viêm gan C mạn tính (CHC) nhưng đã thất bại điều trị. Bệnh nhân không đáp ứng là những người có nồng độ HCV RNA không giảm ít nhất 2 log IU/mL vào tuần điều trị thứ 12, bệnh nhân đáp ứng một phần là những người có nồng độ HCV RNA giảm ít nhất 2 log IU/mL vào tuần điều trị thứ 12 nhưng ở những người này nồng độ HCV RNA vẫn phát hiện được vào tuần điều trị thứ 24; và bệnh nhân tái phát là những người có nồng độ HCV RNA trở nên không phát hiện được trong quá trình điều trị, nhưng sau đó xuất hiện trở lại sau khi kết thúc điều trị. Tính đến các loại này, các thử nghiệm phase 3 cũng đã được thực hiện ở những bệnh nhân bị nhiễm HCV mạn tính genotype 1 đã trải qua điều trị, sử dụng boceprevir và telaprevir kết hợp với PegIFN và ribavirin. Thiết kế thử nghiệm boceprevir bao gồm một phase điều trị dẫn đầu trong 4 tuần bằng PegIFN và ribavirin và so sánh liệu pháp 3 thuốc theo đáp ứng (boceprevir cộng PegIFN và ribavirin trong 32 tuần, bệnh nhân có nồng độ HCV RNA phát hiện vào tuần thứ 8 được điều trị chuẩn thêm 12 tuần) và liệu pháp 3 thuốc trong thời gian cố định điều trị 44 tuần (tổng cộng 48 tuần điều trị) với điều trị chuẩn. Thiết kế thử nghiệm về telaprevir (TVR) gồm ba nhóm: ở nhóm đầu tiên, bệnh nhân được dùng liệu pháp 3 thuốc trong 12 tuần, tiếp theo là điều trị chuẩn trong 36 tuần; ở nhóm thứ hai, bệnh nhân được điều trị dẫn đầu bằng điều trị chuẩn trong 4 tuần, tiếp theo là liệu pháp 3 thuốc trong 12 tuần, kết thúc bằng điều trị chuẩn trong 32 tuần; nhóm thứ ba gồm điều trị chuẩn trong 48 tuần. Trong cả hai thử nghiệm, đáp ứng virus kéo dài xảy ra thường xuyên hơn có ý nghĩa ở những người được dùng liệu pháp 3 thuốc so với những người được điều trị chuẩn. Trong thử nghiệm về boceprevir (BOC) (Thử nghiệm RESPOND-2), tỷ lệ đáp ứng virus kéo dài là 66% và 59% trong hai nhóm dùng liệu pháp 3 thuốc so với 21% ở nhóm chứng, những bệnh nhân tái phát trước đây đã đạt được tỷ lệ đáp ứng virus kéo dài cao hơn (75% và 69% tương ứng) so với bệnh nhân đáp ứng một phần trước đây (52% và 40% tương ứng) khi so với tỷ lệ đã đạt được trong nhóm điều trị chuẩn (29% và 7% tương ứng); những bệnh nhân không đáp ứng đã được loại ra khỏi thử nghiệm này (Bảng 3 và Hình 5). Tương tự, tỷ lệ đáp ứng virus kéo dài trong thử nghiệm về telaprevir (TVR) (Nghiên cứu REALIZE) là 64% và 66% trong nhóm có telaprevir (83% và 88% ở bệnh nhân tái phát, 59% và 54% ở bệnh nhân đáp ứng một phần, và 29% và 33% ở bệnh nhân không đáp ứng) và 17% ở nhóm chứng (24% ở bệnh nhân tái phát, 15% ở bệnh nhân đáp ứng một phần và 5% ở bệnh nhân không đáp ứng) (Hình 6) . Như vậy, đáp ứng với liệu pháp 3 thuốc ở cả hai thử nghiệm boceprevir và telaprevir chịu ảnh hưởng bởi kết quả của điều trị trước đây bằng PegIFN và ribavirin, nhấn mạnh tầm quan trọng của việc xem xét hồ sơ điều trị cũ để ghi nhận đáp ứng điều trị trước đây. Trong thử nghiệm boceprevir, tỷ lệ đáp ứng virus kéo dài cao hơn ở những bệnh nhân tái phát so với ở những bệnh nhân đáp ứng một phần. Ở thử nghiệm telaprevir, tỷ lệ đáp ứng virus kéo dài cao nhất cũng xảy ra ở bệnh nhân tái phát trước đây, tỷ lệ thấp hơn ở bệnh nhân đáp ứng một phần và tỷ lệ thấp nhất ở bệnh nhân không đáp ứng (được định nghĩa là bệnh nhân giảm < 2 log10 về nồng độ HCV RNA vào tuần thứ 12 của điều trị trước đó) (Bảng 3 và Hình 6).
Bảng 3. So sánh thuốc ức chế Protease kết hợp với Peginterferon Alfa (PegIFN) và Ribavirin (RBV) ở bệnh nhân đã trải qua điều trị
Biến số |
Boceprevir (BOC) |
Telaprevir (TVR) |
Thiết kế nghiên cứu |
Thử nghiệm ngẫu nhiên có đối chứng (RCT) |
Thử nghiệm ngẫu nhiên có đối chứng (RCT) |
4 tuần điều trị dẫn đầu bằng PegIFN/RBV |
Có |
Không |
Thời gian dùng liệu pháp 3 thuốc |
32 tuần hoặc 44 tuần kết hợp với PegIFN/RBV** |
12 tuần, tiếp theo là 36 tuần với PegIFN và RBV*** |
Điều trị theo đáp ứng (RGT) |
Có |
Không |
Thích hợp với điều trị theo đáp ứng (%) |
46 |
Không áp dụng (NA) |
Đáp ứng trước đây với PegIFN/RBV (%) |
64 |
53 |
Hiệu quả về đáp ứng virus kéo dài (SVR) (%) Bệnh nhân đáp ứng một phần
Bệnh nhân không đáp ứng |
BOC/PR48: 75 |
T12/PR48: 83 |
Tỷ lệ tái phát chung (%) Bệnh nhân đáp ứng một phần
Bệnh nhân không đáp ứng |
12-15
Không áp dụng (NA)
Không áp dụng (NA) |
Không áp dụng |
Phản ứng phụ |
|
|
Ngừng thuốc (%) |
8-12 |
Không áp dụng (NA) |
Phản ứng phụ nghiêm trọng (%) |
10-14 |
11-15 |
Phản ứng phụ thường gặp hơn |
Thiếu máu, rối loạn vị giác |
Nổi ban, thiếu máu, ngứa, buồn nôn, tiêu chảy |
NA: Không áp dụng; PR: peginterferon cộng ribavirin; RCT: thử nghiệm ngẫu nhiên có đối chứng; SEA : Phản ứng phụ nghiêm trọng; SVR: đáp ứng virus kéo dài.
* Một nhóm dẫn đầu đã được bao gồm trong thử nghiệm tái điều trị bằng telaprevir nhưng chế độ điều trị đã duyệt bởi FDA không bao gồm chiến lược dẫn đầu.
† Thiết kế thử nghiệm boceprevir (BOC) bao gồm một phase điều trị dẫn đầu trong 4 tuần bằng PegIFN và ribavirin (RBV) và so sánh liệu pháp 3 thuốc theo đáp ứng và thời gian cố định trong 44 tuần với liệu pháp peginterferon và ribavirin. Những bệnh nhân dùng liệu pháp boceprevir/điều trị theo đáp ứng (BOC/RGT) đã đạt được đáp ứng virus nhanh mở rộng (eRVR) (nồng độ HCV RNA không phát hiện được vào tuần thứ 8 [tuần thứ 4 của liệu pháp 3 thuốc]) đã được điều trị thêm 24 tuần (điều trị tổng cộng 32 tuần). Nếu không đạt được đáp ứng virus nhanh mở rộng nhưng nồng độ HCV RNA trở nên không phát hiện được vào tuần thứ 12 thì ngừng dùng boceprevir ở tuần thứ 32 và bệnh nhân được điều trị chuẩn thêm trong 12 tuần (điều trị tổng cộng 48 tuần). BOC/PR48: điều trị dẫn đầu trong 4 tuần bằng peginterferon và ribavirin, tiếp theo là liệu pháp 3 thuốc trong thời gian cố định 44 tuần; PR48: PegIFN và ribavirin dùng trong 48 tuần.
‡ Telaprevir (TVR) cộng peginterferon và ribavirin (PR) được dùng có và không có dẫn đầu bằng điều trị chuẩn 4 tuần so với có điều trị chuẩn. T12PR48: Telaprevir được dùng trong 12 tuần, tiếp theo là peginterferon và ribavirin trong 36 tuần; LI-T12/PR48: peginterferon và ribavirin trong 4 tuần, tiếp theo là telaprevir cộng peginterferon và ribavirin trong 12 tuần, kế tiếp là peginterferon và ribavirin trong 32 tuần; PR48: peginterferon và ribavirin dùng trong 48 tuần.

Hình 5. Tỷ lệ chung về đáp ứng virus học kéo dài và ở bệnh nhân tái phát và bệnh nhân đáp ứng một phần, ở những bệnh nhân đã trải qua điều trị nhiễm HCV mạn tính genotype 1: Boceprevir (BOC) cộng peginterferon và ribavirin (PR) so với điều trị chuẩn (SOC). Tất cả bệnh nhân được điều trị lần đầu tiên bằng PegIFN và ribavirin trong 4 tuần dưới dạng điều trị dẫn đầu, tiếp theo là một trong 3 chế độ điều trị: (1) liệu pháp 3 thuốc BOC/PR48 trong 44 tuần. (2) liệu pháp 3 thuốc BOC/RGT trong 32 tuần nếu đạt được đáp ứng virus nhanh mở rộng (eRVR) (nồng độ HCV RNA không phát hiện được vào tuần thứ 8 và 12). Nếu không đạt được đáp ứng virus nhanh mở rộng nhưng nồng độ HCV RNA trở nên không phát hiện được vào tuần thứ 12 thì ngừng điều trị boceprevir ở tuần thứ 32 và bệnh nhân được điều trị chuẩn thêm 12 tuần (điều trị tổng cộng 48 tuần). (3) Điều trị chuẩn gồm PegIFN và ribavirin dùng trong 48 tuần.
Như vậy, quyết định tái điều trị bệnh nhân nên tùy thuộc vào đáp ứng trước đây của họ với PegIFN và ribavirin cũng như vào lý do tại sao có thể họ đã thất bại, chẳng hạn như liều thuốc không đủ hoặc xử trí tác dụng phụ không thỏa đáng. Những bệnh nhân tái phát và bệnh nhân đáp ứng một phần có thể hy vọng tỷ lệ đáp ứng virus kéo dài tương đối cao với chế độ điều trị bằng 3 thuốc có chứa chất ức chế protease (PI) và nên được xem xét là các đối tượng cho việc tái điều trị. Quyết định tái điều trị một bệnh nhân không đáp ứng nên tùy theo từng cá nhân, đặc biệt là ở bệnh nhân xơ gan, vì ít hơn một phần ba bệnh nhân không đáp ứng trong thử nghiệm về telaprevir (TVR) đạt được đáp ứng virus kéo dài; không có số liệu tương đương đối với thử nghiệm về boceprevir (BOC) vì những bệnh nhân không đáp ứng đã bị loại ra khỏi việc điều trị. Ngoài ra, đa số bệnh nhân không đáp ứng phát triển kháng thuốc kháng virus. Tuy nhiên, nhãn được FDA phê duyệt cho thấy boceprevir có thể được sử dụng ở bệnh nhân không đáp ứng nhưng do thiếu thông tin rõ ràng từ dữ liệu phase 3, cần thận trọng khi sử dụng boceprevir ở bệnh nhân không đáp ứng cho đến khi có chứng cứ hỗ trợ thêm. Do đó, phải cân nhắc bất kỳ lợi ích tiềm năng nào từ việc điều trị cho bệnh nhân không đáp ứng so với nguy cơ phát triển kháng thuốc kháng virus cùng các tác dụng phụ nghiêm trọng và chi phí điều trị cao.
Điều trị theo đáp ứng, dựa trên sự đạt được đáp ứng virus nhanh mở rộng đã được đánh giá cho tái điều trị trong thử nghiệm về boceprevir (BOC). Việc rút ngắn thời gian điều trị từ tiêu chuẩn 48 tuần xuống còn 36 tuần ở những bệnh nhân được dùng liệu pháp 3 thuốc và những người đạt được đáp ứng virus nhanh mở rộng (là đáp ứng mà đối với thuốc này được định nghĩa là nồng độ HCV RNA âm tính từ tuần thứ 8 đến 20) đã không làm giảm đáng kể tỷ lệ đáp ứng virus kéo dài (59% đối với điều trị theo đáp ứng (RGT) so với 66% đối với điều trị trong thời gian cố định). Tuy nhiên, ở bệnh nhân xơ gan, tỷ lệ đáp ứng virus kéo dài thấp hơn về mặt thống kê ở những người được điều trị theo đáp ứng so với những người được điều trị trong thời gian đầy đủ là 48 tuần (35% so với 77% tương ứng). Sự xuất hiện các biến thể kháng boceprevir thường gặp hơn ở bệnh nhân đáp ứng kém với điều trị bằng interferon (giảm <1 log về nồng độ HCV RNA) trong phase dẫn đầu và những người được điều trị theo đáp ứng (RGT) so với những người giảm > 1 log về nồng độ HCV RNA và điều trị trong 48 tuần (32% và 8% tương ứng). Không có dữ liệu tương đương đối với điều trị theo đáp ứng sử dụng telaprevir. Tuy nhiên, tỷ lệ đáp ứng virus kéo dài ít nhất là cao ở bệnh nhân tái phát giống như tỷ lệ ở bệnh nhân chưa từng điều trị, và sự tiếp xúc với telaprevir là 12 tuần với cả hai lựa chọn điều trị theo đáp ứng (RGT) và điều trị trong 48 tuần. Do đó, mặc dù không có dữ liệu trực tiếp để hỗ trợ cho khuyến cáo là bệnh nhân tái phát có thể được điều trị bằng telaprevir, sử dụng cách tiếp cận điều trị theo đáp ứng, FDA không xác nhận khuyến cáo như vậy, như là trường hợp đối với boceprevir.
III.Lợi ích của chiến lược dẫn đầu
Có sự không chắc chắn về lợi ích của phase dẫn đầu. Về mặt lý thuyết, một phase dẫn đầu bằng PegIFN và ribavirin có thể có lợi cho việc cải thiện hiệu quả điều trị do việc làm giảm nồng độ HCV RNA sẽ cho phép nồng độ PegIFN và ribavirin ở trạng thái ổn định tại thời điểm sử dụng thuốc ức chế protease (PI), do đó làm giảm nguy cơ bùng phát virus hoặc đề kháng. Ngoài ra, một chiến lược dẫn đầu cho phép xác định đáp ứng với interferon và đánh giá đáp ứng virus kéo dài trong thời gian điều trị ở những bệnh nhân được dùng boceprevir hoặc telaprevir. Những bệnh nhân có đáp ứng interferon tối ưu, được định nghĩa là giảm nồng độ HCV RNA dưới 1 log trong 4 tuần điều trị dẫn đầu, có tỷ lệ đáp ứng virus kéo dài thấp hơn so với bệnh nhân có đáp ứng tốt với interferon trong thời gian điều trị dẫn đầu. Tuy nhiên, việc cộng thêm boceprevir cho bệnh nhân đáp ứng kém trong thời gian điều trị dẫn đầu vẫn dẫn đến cải thiện đáng kể tỷ lệ đáp ứng virus kéo dài (28% - 38% so với 4% nếu không cộng thêm một thuốc ức chế protease), vì vậy không nên dùng đáp ứng kém trong giai đoạn dẫn đầu để từ chối bệnh nhân tiếp cận với phương pháp điều trị bằng thuốc ức chế protease.
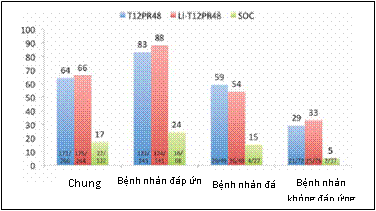
Hình 6. Tỷ lệ chung về đáp ứng virus kéo dài (SVR) và ở các bệnh nhân tái phát, bệnh nhân đáp ứng một phần và bệnh nhân không đáp ứng trong các bệnh nhân bị nhiễm HCV mạn tính genotype 1 đã trải qua điều trị. T12PR48: Telaprevir (TVR) cộng peginterferon và ribavirin (PR) được dùng trong 12 tuần, tiếp theo là 36PR trong 12 tuần, kế tiếp là PR trong 32 tuần; điều trị chuẩn gồm PegIFN và ribavirin dùng trong 48 tuần.
Tuy nhiên, một sự so sánh trực tiếp về các nhóm có điều trị dẫn đầu và không điều trị dẫn đầu trong nghiên cứu về boceprevir (BOC) phase 2 đã không cho thấy sự khác biệt đáng kể về tỷ lệ đáp ứng virus kéo dài là 56% và 54% đối với chế độ điều trị 28 tuần hoặc 75% và 67% đối với chế độ điều trị 48 tuần, có và không có điều trị dẫn đầu tương ứng. Kết hợp dữ liệu của tất cả các nhóm điều trị trong thử nghiệm phase 2 đã chứng minh một xu hướng tỷ lệ bùng phát virus cao hơn ở những bệnh nhân được điều trị bằng boceprevir không có điều trị dẫn đầu là 9%, so với ở những bệnh nhân được điều trị dẫn đầu là 4% (P = 0.06). Tuy nhiên, do tất cả dữ liệu phase 3 được dựa trên chiến lược dẫn đầu, cho đến khi có bằng chứng ngược lại, nên sử dụng boceprevir với điều trị dẫn đầu trong 4 tuần. Chiến lược dẫn đầu không được đánh giá trong thử nghiệm cho bệnh nhân chưa từng điều trị telaprevir phase 3, vì vậy không có khuyến cáo nào có thể được đưa ra đối với thuốc này.
Khuyến cáo:
Đối với bệnh nhân đã trải qua điều trị
10. Có thể khuyến cáo tái điều trị bằng boceprevir hoặc telaprevir cùng với peginterferon alfa và ribavirin dựa trên cân nặng cho bệnh nhân có tái phát virus hoặc bệnh nhân đáp ứng một phần sau một liệu trình điều trị trước đây bằng interferon alfa chuẩn hoặc peginterferon alfa và/hoặc ribavirin (Loại 1, Mức độ A).
11. Có thể xem xét tái điều trị bằng telaprevir cùng với peginterferon alfa và ribavirin dựa trên cân nặng cho bệnh nhân không đáp ứng trước đây với một liệu trình điều trị bằng interferon alfa chuẩn hoặc peginterferon alfa và/hoặc ribavirin dựa trên cân nặng (Loại 2b, Mức độ B.)
12. Có thể xem xét điều trị theo đáp ứng ở những bệnh nhân đã trải qua điều trị bằng cách sử dụng một chế độ điều trị dựa trên boceprevir hoặc telaprevir cho bệnh nhân tái phát (Loại 2a, Mức độ B đối với boceprevir, Loại 2b, Mức độ C đối với telaprevir), cho bệnh nhân đáp ứng một phần (Loại 2b, Mức độ B đối với boceprevir; Loại 3, Mức độ C đối với telaprevir), nhưng không thể khuyến cáo cho bệnh nhân không đáp ứng (Loại 3, Mức độ C).
13. Nên ngừng tất cả điều trị ở bệnh nhân được tái điều trị bằng boceprevir cộng peginterferon alfa và ribavirin mà tiếp tục có nồng độ HCV RNA> 100 IU phát hiện được vào tuần thứ 12 do khả năng cao về phát triển đề kháng thuốc kháng virus (Loại 1, Mức độ B).
14. Nên ngừng tất cả điều trị ở bệnh nhân được tái điều trị bằng telaprevir cộng peginterferon alfa và ribavirin mà tiếp tục có nồng độ HCV RNA> 1.000 IU phát hiện được vào tuần thứ 4 hoặc 12 do khả năng cao về phát triển đề kháng thuốc kháng virus (Loại 1, Mức độ B).
IV.Phản ứng phụ
Các phản ứng phụ xảy ra thường xuyên hơn ở những bệnh nhân được điều trị bằng thuốc ức chế protease (PI) so với những người được điều trị bằng PegIFN và ribavirin dùng đơn độc. Trong thử nghiệm về boceprevir (BOC), thiếu máu và rối loạn vị giác là những phản ứng phụ thường gặp nhất, trong khi ở thử nghiệm telaprevir (TVR) thì phát ban, thiếu máu, ngứa, buồn nôn, và tiêu chảy thường gặp hơn ở những người được dùng telaprevir so với những người được điều trị chuẩn. Trong những thử nghiệm telaprevir phase 3, đã ghi nhận phát ban ở bất kỳ mức độ nào ở 56% bệnh nhân dùng chế độ điều trị dựa trên telaprevir so với 32% ở bệnh nhân dùng chế độ điều trị bằng PegIFN và ribavirin. Ban có đặc điểm dạng eczema và dát sần điển hình, phù hợp với phát ban do thuốc. Ở hầu hết bệnh nhân, ban ở mức độ từ nhẹ đến trung bình nhưng ở mức độ nặng trong 4% trường hợp (liên quan đến > 50% diện tích bề mặt cơ thể). Sự phát triển ban đòi hỏi phải ngừng telaprevir trong 6% trường hợp và ngừng toàn bộ chế độ điều trị trong 1% trường hợp. Hội chứng Stevens Johnson hoặc phát ban liên quan đến thuốc với triệu chứng toàn thân (DRESS) xảy ra < 1% bệnh nhân nhưng ở một tần suất cao hơn so với thường quan sát thấy đối với các loại thuốc khác. Đáp ứng phát ban đối với điều trị tại chỗ hoặc toàn thân bằng corticosteroid và thuốc kháng histamin dạng uống không chắc chắn. Ngứa thường gặp nhưng không phải luôn luôn đi kèm với phát ban đã được ghi nhận ở ~50% bệnh nhân được điều trị bằng telaprevir. Thiếu máu phát triển ở những người được dùng cả hai thuốc ức chế protease. Hemoglobin dưới 10 g/dL (độc tính cấp độ 2) đã xảy ra ở 49% bệnh nhân được dùng chế độ điều trị bằng boceprevir so với 29% bệnh nhân được điều trị chuẩn, trong khi 9% bệnh nhân có giảm hemoglobin < 8,5 g/dL (độc tính cấp độ 3). Trong số những bệnh nhân được điều trị bằng T12PR, đã quan sát thấy nồng độ hemoglobin <10 g/dL ở 36% bệnh nhân so với 14% bệnh nhân điều trị chuẩn và 9% bệnh nhân có hemoglobin giảm đến < 8,5 g/dL. Do các yếu tố tăng trưởng tạo máu không được cho phép trong các thử nghiệm với telaprevir, có một tỷ lệ cao hơn về ngừng điều trị là 5% - 6% ở những người phát triển thiếu máu so với những người không bị thiếu máu. Tuy nhiên, không phải thiếu máu cũng không phải sự giảm liều ribavirin đã ảnh hưởng bất lợi đến tỷ lệ đáp ứng virus kéo dài. Lưu ý là trong thử nghiệm với boceprevir, tỷ lệ đáp ứng virus kéo dài ở những bệnh nhân được xử lý bằng cách giảm liều ribavirin đơn độc đã được so sánh với tỷ lệ đáp ứng virus kéo dài ở những bệnh nhân được xử trí bằng liệu pháp erythropoietin.23 Tương tự, trong các thử nghiệm với telaprevir, sự giảm liều ribavirin không ảnh hưởng đến tỷ lệ đáp ứng virus kéo dài, vì vậy việc giảm liều nên là đáp ứng ban đầu để xử trí thiếu máu. Do thời gian điều trị bằng boceprevir (24-44 tuần) dài hơn thời gian điều trị bằng telaprevir (12 tuần), tần suất thiếu máu có khả năng cao hơn trong chế độ điều trị bằng boceprevir, dẫn đến giảm liều ribavirin thêm nữa và xem xét sử dụng erythropoietin. Tuy nhiên, phải cân nhắc lợi ích tiềm năng của erythropoietin so với các tác dụng phụ tiềm ẩn của nó, thực tế là việc sử dụng erythropoietin trong điều trị HCV chưa được FDA chấp thuận, và chi phí đáng kể của nó. Nếu xảy ra phản ứng phụ làm hạn chế việc điều trị bằng thuốc ức chế protease, có thể tiếp tục PegIFN và ribavirin với điều kiện là có đáp ứng trong thời gian điều trị. Chưa có dữ liệu giúp hướng dẫn thay thế bằng một thuốc ức chế HCV protease khác. Nếu bệnh nhân có phản ứng phụ nghiêm trọng liên quan với PegIFN và/hoặc ribavirin, phải giảm liều hoặc ngừng dùng PegIFN và/hoặc ribavirin. Nếu ngừng một trong hai PegIFN và/hoặc ribavirin, phải ngừng dùng thuốc ức chế HCV protease. Thông tin bổ sung về việc xử trí các phản ứng phụ khác có thể được tìm thấy trong tờ hướng dẫn sử dụng.
V.Tương tác thuốc-thuốc
Do bệnh nhân bị viêm gan C mạn tính thường xuyên nhận được các loại thuốc bổ sung vào những thuốc được sử dụng để điều trị nhiễm HCV và do các thuốc ức chế protease có thể ức chế enzyme chuyển hóa thuốc của gan như cytochrome P450 2C (CYP2C), CYP3A4 hoặc CYP1A, cả hai boceprevir và telaprevir đã được nghiên cứu về những tương tác tiềm năng với một số thuốc có khả năng được dùng kết hợp. Những thuốc này bao gồm các statin, thuốc ức chế miễn dịch, thuốc được sử dụng để điều trị đồng nhiễm HIV, nhiễm trùng cơ hội, rối loạn khí sắc và thuốc hỗ trợ cai nghiện ma túy. Đã ghi nhận cả hai boceprevir và telaprevir gây ra tương tác với một số các loại thuốc được kiểm tra, làm tăng hoặc giảm các thông số dược động học. Vì vậy, điều đặc biệt quan trọng là các nhà cung cấp dịch vụ y tế cần xem xét thông tin này được liệt kê trong tờ hướng dẫn sử dụng đối với từng loại thuốc trước khi bắt đầu điều trị viêm gan C mạn tính. Có thể xem thông tin này tại trang web của FDA: http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm. Các trang web hữu ích khác là: http//: 222.drug interactions.com và http://www.hep-druginteractions.org
VI.Đề kháng virus và theo dõi sự đề kháng virus
Sự xuất hiện các biến thể kháng thuốc kháng virus trong trị liệu dựa trên thuốc ức chế protease đã được quan sát thấy trong tất cả các thử nghiệm và có liên quan với thất bại về mặt virus và sự tái phát của virus (Bảng 2 và 3). Các đột biến mang đề kháng ở mức cao hoặc thấp đến cụm boceprevir và telaprevir xung quanh các vị trí xúc tác của NS3/4A serine protease. Các biến thể tương tự đã được phát hiện ở những đối tượng được điều trị bằng boceprevir và telaprevir, cho thấy có một số mức độ đề kháng chéo giữa hai thuốc ức chế protease. Trong cả hai nghiên cứu phase 3, phân tích trình tự của vùng NS3/4A đã được thực hiện trong tất cả đối tượng ở mức cơ bản và ở tất cả đối tượng không đạt được đáp ứng virus kéo dài. Các biến thể kháng thuốc kháng virus được phát hiện ở một tỷ lệ nhỏ bệnh nhân ở mức cơ bản, 7% trong các nghiên cứu về boceprevir và 5% trong các thử nghiệm về telaprevir nhưng dường như không ảnh hưởng đến đáp ứng của mỗi thuốc ức chế protease. Vì vậy, hiện nay chưa có chỉ định lâm sàng cho xét nghiệm tính kháng thuốc ở mức cơ bản.
Ở những bệnh nhân chưa từng điều trị được cho dùng liệu pháp boceprevir, đã quan sát thấy các biến thể kháng thuốc kháng virus phát triển trong thời gian điều trị về mặt tổng thể ở 16% bệnh nhân (Bảng 2). Trong thời gian điều trị, các biến thể kháng thuốc kháng virus liên quan với telaprevir xảy ra ở 12% bệnh nhân chưa từng điều trị và 22% bệnh nhân đã trải qua điều trị (Bảng 2 và 3). Đa số bệnh nhân (80%-90%) trải qua sự bùng phát virus hoặc ức chế virus không hoàn toàn khi đang điều trị, hoặc tái phát virus sau khi ngừng điều trị thuốc ức chế protease, đã được tìm thấy có các biến thể kháng thuốc kháng virus. Trong các nghiên cứu về boceprevir, đáp ứng kém với interferon (giảm <1 log về nồng độ HCV RNA trong phase điều trị dẫn đầu) có kèm theo một tỷ lệ phát triển kháng thuốc cao hơn.12 Ở những bệnh nhân được điều trị bằng telaprevir, việc xác định trình tự ở nhóm nghiên cứu cho thấy sự đề kháng ở mức độ cao phát triển phổ biến hơn khi sự thất bại virus xảy ra trong thời gian 12 tuần điều trị đầu tiên, trong khi các biến thể đề kháng ở mức thấp có nhiều khả năng khi sự thất bại virus xảy ra muộn hơn, trong thời gian điều trị bằng PegIFN và ribavirin đơn độc. Những quan sát này làm nổi bật tầm quan trọng của đáp ứng với interferon để dự phòng sự xuất hiện kháng thuốc kháng virus.
Ý nghĩa lâm sàng của các biến thể kháng thuốc kháng virus xuất hiện trong quá trình điều trị bằng thuốc ức chế protease không chắc chắn. Trong nghiên cứu theo dõi theo thời gian trên những bệnh nhân tham gia vào thử nghiệm phase 2, các biến thể kháng boceprevir đã được phát hiện ở 43% đối tượng sau 2 năm theo dõi. Tương tự, ở những bệnh nhân có các biến thể kháng telaprevir đã được chứng minh tham gia vào thử nghiệm telaprevir phase 3, 40% bệnh nhân vẫn còn các biến thể kháng thuốc có thể phát hiện được sau một thời gian theo dõi trung bình 45 tuần. Nhìn chung, sự giảm hoặc mất các biến thể dường như có liên quan với mức độ khỏe mạnh của họ.
Cần có các dữ liệu thêm để xác định có phải sự lựa chọn các biến thể này trong và sau khi điều trị bằng thuốc ức chế protease ảnh hưởng đến những lựa chọn điều trị sau đó hay không. Trong những nghiên cứu phase 3, sự xuất hiện các biến thể kháng thuốc và bùng phát virus thường gặp hơn ở những bệnh nhân bị nhiễm HCV nhóm phụ (subtype) 1a so với 1b, là kết quả của rào cản di truyền cao hơn cần cho sự lựa chọn biến thể kháng thuốc trong nhóm 1b của HCV so với 1a. Vì vậy, việc xác định nhóm phụ HCV có thể đóng một vai trò trong việc giúp lựa chọn chế độ điều trị trong tương lai và dự đoán sự phát triển kháng thuốc. Cuối cùng, việc giảm thiểu phát triển đột biến bù trừ sẽ liên quan đến việc ngừng sử dụng sớm việc điều trị bằng thuốc ức chế protease khi điều trị kháng virus không chắc thành công. Mặc dù các quy tắc ngừng trị liệu kháng virus thay đổi nhiều trong thử nghiệm phase 2 và 3, các thời điểm tuần thứ 4 và 12 trong liệu pháp 3 thuốc vẫn là thời điểm quyết định quan trọng để ngừng điều trị dựa trên nồng độ HCV RNA. Dữ liệu hiện tại cho thấy rằng đối với bệnh nhân đang dùng boceprevir, nên ngừng điều trị vào tuần thứ 12 nếu nồng độ virus > 100 IU/mL hoặc > 10-15 IU/mL vào tuần điều trị thứ 24. Đối với telaprevir, nên ngừng điều trị vào tuần thứ 4 hoặc 12 nếu nồng độ virus > 1.000 IU/mL hoặc nếu nồng độ HCV RNA còn phát hiện được vào tuần thứ 24.
Khuyến cáo:
15. Những bệnh nhân phát sinh thiếu máu khi đang điều trị viêm gan C mạn tính dựa trên thuốc ức chế protease cần được xử trí bằng cách giảm liều ribavirin (Loại 2a, Mức độ A).
16. Cần theo dõi chặt chẽ những bệnh nhân đang điều trị dựa trên thuốc ức chế protease về nồng độ HCV RNA và phải ngừng thuốc ức chế protease nếu quan sát thấy bùng phát virus (HCV RNA trong huyết thanh tăng > 1 log cao hơn trị số thấp nhất đạt được trong thời gian điều trị) (Loại 1, Mức độ A).
17. Không nên tái điều trị với một thuốc ức chế protease khác ở những bệnh nhân không có đáp ứng về virus học, bệnh nhân đã trải qua sự bùng phát virus, hoặc những bệnh nhân tái phát khi đang điều trị bằng một thuốc ức chế protease(Loại 2a, Mức độ C).
VII.Vai trò của xét nghiệm IL28B trong việc quyết định điều trị và lựa chọn chế độ điều trị
Khả năng đạt được đáp ứng virus kéo dài với PegIFN và ribavirin và khỏi nhiễm HCV một cách tự nhiên khác nhau tùy thuộc vào trình tự nucleotide gần gen đối với IL28B hoặc lambda interferon 3 trên nhiễm sắc thể 19.18,19. Một đa hình đơn nucleotide được dự đoán cao là phát hiện của alen C hoặc T ở vị trí rs12979860. Genotype CC được tìm thấy nhiều hơn hai lần như thường gặp ở những người đã khỏi nhiễm HCV một cách tự nhiên so với những người tiến triển đến viêm gan C mạn tính. Trong số những người nhiễm HCV mạn tính genotype 1 được điều trị bằng PegIFN và ribavirin, đáp ứng virus kéo dài đã đạt được ở 69%, 33% và 27% người da trắng có CC, CT và các genotype TT tương ứng; trong số các bệnh nhân da đen, tỷ lệ đáp ứng virus kéo dài là 48%, 15% và 13% đối với CC, CT và genotype TT tương ứng. Giá trị dự đoán của xét nghiệm genotype IL28B về đáp ứng virus kéo dài trội hơn giá trị dự đoán của nồng độ HCV RNA trước điều trị, giai đoạn xơ hóa, tuổi, giới và cao hơn đối với virus viêm gan C (HCV) genotype 1 so với virus genotype 2 và 3. Có các đa hình khác gần gen đối với IL28B cũng dự báo đáp ứng virus kéo dài, bao gồm sự phát hiện alen G hoặc T ở vị trí rs8099917, là nơi T là genotype thuận lợi và chủ yếu cung cấp cùng thông tin ở người da trắng như C ở vị trí rs12979860.
Trong một nghiên cứu, cũng như trong phân tích sơ bộ các dữ liệu đăng ký phase 3, genotype IL28B vẫn là yếu tố dự đoán về đáp ứng virus kéo dài ngay cả ở những người dùng boceprevir hoặc telaprevir. Ở những bệnh nhân da trắng được chọn ngẫu nhiên vào thử nghiệm SPRINT 2 được dùng boceprevir trong 48 tuần, đáp ứng virus kéo dài đã đạt được là 80%, 71% và 59% bệnh nhân với genotype CC, CT và TT tương ứng. Ở những bệnh nhân da trắng được chọn ngẫu nhiên vào thử nghiệm ADVANCE được dùng telaprevir trong 12 tuần, đáp ứng virus kéo dài đã đạt được là 90%, 71% và 73% ở bệnh nhân có genotype CC, CT và TT tương ứng. Genotype IL28B cũng dự đoán khả năng hội đủ điều kiện cho điều trị theo đáp ứng. Ở bệnh nhân da trắng chưa từng điều trị được chọn ngẫu nhiên vào thử nghiệm SPRINT 2 với boceprevir, ngưỡng HCV RNA vào tuần thứ 8 đã đạt được ở 89% và 52% bệnh nhân có genotype CC và CT/TT tương ứng. Ở bệnh nhân da trắng chưa từng điều trị được chọn ngẫu nhiên vào nghiên cứu ADVANCEvới telaprevir, đáp ứng virus nhanh mở rộng đã đạt được ở 78%, 57% và 45% bệnh nhân với genotype CC, CT và TT tương ứng. Mặc dù genotype IL28B cung cấp thông tin liên quan đến khả năng của đáp ứng virus kéo dài và điều trị rút ngắn thời gian có thể là quan trọng với nhà cung cấp và bệnh nhân, nhưng chưa có đủ dữ liệu để hỗ trợ việc ngừng chất ức chế protease ở những người có genotype CC thuận lợi do tiềm năng rút ngắn thời gian điều trị và xu hướng tỷ lệ đáp ứng virus kéo dài cao hơn đã được quan sát thấy trong nghiên cứu với telaprevir. Ngoài ra, giá trị dự đoán âm tính của alen T với điều trị bao gồm thuốc ức chế protease không đủ cao để hạn chế điều trị cho tất cả bệnh nhân, vì đáp ứng virus kéo dài đã đạt được ở hơn một nửa số người da trắng có genotype TT.
Tóm lại, những dữ liệu này cho thấy genotype IL28B là một yếu tố dự báo đáp ứng với điều trị đáng kể trước điều trị. Cần xem xét để yêu cầu xét nghiệm khi nó có khả năng ảnh hưởng đến quyết định của bác sĩ hoặc quyết định của bệnh nhân để bắt đầu điều trị. Chưa có đủ dữ liệu để xác định có phải xét nghiệm IL28B có thể được sử dụng để khuyến cáo lựa chọn điều trị chuẩn theo chế độ điều trị dựa trên thuốc ức chế protease với một genotype thuận lợi (CC) và trong việc quyết định về thời gian điều trị với mỗi chế độ điều trị hay không.
Khuyến cáo:
18. Genotype IL28B là một yếu tố dự báo mạnh trước điều trị về đáp ứng virus kéo dài đối với peginterferon alfa và ribavirin cũng như với liệu pháp 3 thuốc ức chế protease ở những bệnh nhân bị nhiễm virus viêm gan C mạn tính genotype 1. Xét nghiệm có thể được xem xét khi bệnh nhân hoặc nhà cung cấp mong muốn thông tin bổ sung về khả năng đáp ứng điều trị hoặc thời gian điều trị cần thiết (Loại 2a, Mức độ B).
VIII.Nhóm bệnh nhân đặc biệt
Còn ít thông tin đối với nhiều phân nhóm có nhu cầu điều trị lớn nhất chưa được đáp ứng (ví dụ bệnh nhân đồng nhiễm HIV và HCV, bệnh nhân xơ gan mất bù và bệnh nhân sau ghép gan). Dữ liệu từ các thử nghiệm phase 1 và phase 2 cung cấp thông tin tạm thời có thể hướng dẫn các vấn đề điều trị liên quan. Boceprevir và telaprevir chuyển hóa mạnh ở gan, Boceprevir chủ yếu chuyển hóa qua hệ thống aldoketoreductase (AKR) nhưng còn qua hệ thống enzyme cytochrome P450, trong khi telaprevir chỉ được chuyển hóa bởi hệ thống enzyme cytochrome P450, đường đào thải chính là qua phân và bài tiết rất ít qua nước tiểu. Vì vậy, không cần điều chỉnh liều boceprevir hoặc telaprevir ở bệnh nhân suy thận. Không quan sát thấy sự khác biệt có ý nghĩa lâm sàng về các thông số dược động học với các mức độ khác nhau về suy gan mạn tính ở bệnh nhân được điều trị bằng boceprevir, vì vậy không cần điều chỉnh liều của thuốc này ở bệnh nhân bị xơ gan và suy gan. Mặc dù có thể sử dụng telaprevir để điều trị bệnh nhân suy gan nhẹ (thang điểm Child-Turcotte-Pugh loại A, điểm số 5 hoặc 6), không nên sử dụng telaprevir ở bệnh nhân nhiễm HCV bị suy gan từ trung bình đến nặng vì không có dữ liệu dược động học hoặc dữ liệu an toàn về việc sử dụng thuốc ở những bệnh nhân này. Như đã lưu ý ở trên, boceprevir và telaprevir là hai thuốc ức chế CYP3A4, cần thận trọng khi sử dụng đồng thời với các thuốc đã biết là cơ chất của CYP3A4 và cần theo dõi lâm sàng chặt chẽ. Tương tác dược động học có ý nghĩa đặc biệt ở nhóm bệnh nhân đồng nhiễm HIV và bệnh nhân được ghép cho nên bất kỳ việc sử dụng boceprevir hoặc telaprevir ở nhóm bệnh nhân được ghép hay bệnh nhân đồng nhiễm HIV cần được thực hiện thận trọng và dưới sự theo dõi lâm sàng chặt chẽ. Không khuyến cáo sử dụng telaprevir và boceprevir cho trẻ em và thiếu niên dưới 18 tuổi vì chưa xác định được sự an toàn và hiệu quả ở nhóm bệnh nhân này. Vì vậy, trong khi boceprevir và telaprevir có nhiều hứa hẹn cho việc cải thiện đáp ứng virus kéo dài ở các nhóm bệnh nhân đặc biệt, nhiều vấn đề điều trị phức tạp vẫn còn được đánh giá trong các thử nghiệm thêm phase 2 và 3.